Eksport Produktów Farmaceutycznych – sukces branży, czy słabość systemu?
AUTOR: Andrzej Kochanek (AK)
Jak wynika z danych GUS, rok 2017 był dla Polski rekordowym rokiem wzrostu eksportu produktów farmaceutycznych, z wynikiem około 16,8 mld PLN i wzrostem o ponad 43% rok do roku. Ostatnie trzy lata 2014-2016 były w miarę stabilne na poziomie 11-12 mld PLN. Natomiast ostatni rok to skok praktycznie do tej pory nienotowany. Ostatni duży wzrost powyżej 25% odnotowano za 2013, tuż po wprowadzeniu nowej ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych w 2012. Eksport jako taki jest zjawiskiem jak najbardziej pożądanym, wpływa korzystnie na saldo handlu zagranicznego oraz rozwój gospodarczy kraju.
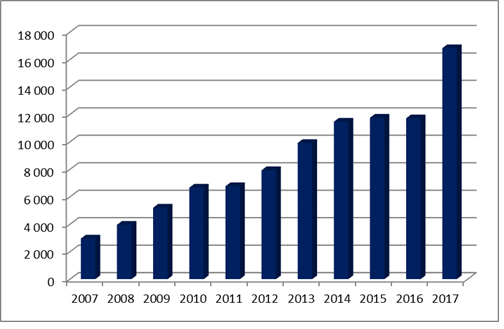
GUS, Eksport – Produkty Farmaceutyczne w latach 2007-2017 w mln PLN (klasyfikacja CN, dział 30)
W farmacji mamy jednak kilka odcieni tego zagadnienia zwłaszcza, że o eksporcie produktów farmaceutycznych mówi się dużo w kontekście braku dostępności określonych leków na rynku.
Rozpoczynając dyskusje o eksporcie w farmacji warto podkreślić, że mamy duży i ciągle rosnący eksport, w którym to nasi producenci znajdują rynek zbytu dla swoich produktów za granicą. Inwestycje w rozwój, dobre wykorzystanie szans związanych z rozwojem wspólnego rynku unijnego, w tym dotacji, ekspansja na nowe rynki poza unią – są szansą rozwoju dla wielu firm i jak widać szansą wykorzystaną. Pozytywne informacje o eksporcie napływają z różnych firm np. Polpharma, Adamed, Grupa TZMO, GlaxoSmithKline Pharmaceuticals, Herbapol Wrocław czy Bioton (źródło: Business Insider Polska/Puls Biznesu/ rynekaptek.pl).
Oprócz producentów jest również duża grupa dystrybutorów, która znajduje zbyt za granicą dla produktów farmaceutycznych dostępnych na rynku Polskim. Rynek równoległy pojawił się wraz z wejściem Polski do Unii Europejskiej w 2004 roku. Pierwszym objawem zmian na rynku był ponowny wzrostu ilości aktywnie działających hurtowni farmaceutycznych, która wcześniej ze względu na fuzje i integracje systematycznie malała.
Pierwsze próby monitorowania rynku równoległego pojawiły się tuż potem w 2006 roku. Firmy monitorujące rynek informowały, że eksport równoległy rósł dynamicznie i co roku niemal się podwajał by 2010 roku osiągnąć około 800 mln PLN (źródło IMS obecnie IQVIA), a był to wciąż początek koła zamachowego eksportu leków. W owym czasie tak hurtownie jak i apteki mogły jeszcze swobodnie zajmować się sprzedażą i odsprzedażą leków na cele eksportowe.
Producenci starając się zagwarantować ciągłość sprzedaży swoich preparatów uruchomili, znane już z innych rynków różne formy dedykowanych kanałów dystrybucji (DTP Direct to Pharmacy, DTH Direct to Hospital, lub LWA Limited Wholesale Agreement). Trzeba dodać, że jest to trudny temat balansowania między prawem konkurencji, a zobowiązaniem zapewnienia dostępności wynikającym z refundacji. Pracując z naszymi klientami wiemy, że w niektórych przypadkach pomimo dostarczania danego produktu w ilości przekraczającej znacznie zapotrzebowanie rynku w Polsce, nawet 30-50% całości dostaw trafiało na inne rynki, odnotowywane tam jako import równoległy. Z drugiej strony rozmawiając z wieloma farmaceutami z aptek które, nie były zaangażowane w działania eksportowe, rozumiemy, że takie rozwiązania są odbierane jako agresywne narzucanie określonych wymagań i nieuprawnione ingerowanie w działania apteki. W niektórych tego typu systemach udało się jednak znaleźć rodzaj stabilnej równowagi z poszanowaniem obu stron.
Do omówienia postępujących zmian w prawie zaprosiliśmy Katarzynę Czyżewską (KC), adwokata i wspólnika kancelarii Czyżewscy, posiadającego wieloletnie doświadczenie w doradztwie na rzecz podmiotów z sektora szeroko pojętego Life Sciences.

KC: Na początek trzeba stwierdzić, że eksport równoległy był, jest i zapewne nadal będzie w pełni legalny (oczywiście, o ile spełnia warunki opisane w prawie). Geneza tego zjawiska tkwi w prawie wspólnotowym, a dokładniej: w zasadzie swobody przepływu towarów w Unii Europejskiej. Zasada ta, obecnie normowana w artykule 28 i kolejnych Traktatu o funkcjonowaniu Unii Europejskiej, zakazuje stosowania pomiędzy państwami członkowskimi Unii Europejskiej ceł przywozowych i wywozowych lub środków o skutku równoważnym, a także ograniczeń ilościowych w wywozie i przywozie towarów i środków o skutku równoważnym.
Skoro, w świetle powyższych przepisów, towary mogą swobodnie przepływać pomiędzy państwami członkowskimi Unii Europejskiej, to zdaniem Trybunału Sprawiedliwości Unii Europejskiej również praktyka kupowania produktów dystrybuowanych legalnie w jednym państwie członkowskim, w celu ich odsprzedaży w innym państwie, powinna być uznana za działanie w pełni legalne. Na tym właśnie polega handel równoległy (tzn. niezależny od oficjalnego, kontrolowanego przez producenta, łańcucha dystrybucji).
Orzecznictwo Trybunału Sprawiedliwości przyczyniło się do rozwoju instytucji handlu (importu i eksportu) równoległego, precyzując jednocześnie warunki, jakie powinien spełnić eksporter lub importer, aby móc taką działalność prowadzić. Obecnie zasady wprowadzania do obrotu w Polsce leków z importu równoległego są określone w przepisach Prawa farmaceutycznego; natomiast eksportując leki z Polski do innych państw członkowskich eksporter powinien spełnić wymagania wynikające z przepisów kraju docelowego.
Problemy z eksportem równoległym z Polski rozwinęły się na dobre po wejściu w życie Ustawy o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych w 2012 roku. Największym sukcesem Ustawy (przynajmniej z perspektywy publicznego płatnika) były duże obniżki cen urzędowych na leki refundowane.
AK: Różnice w cenach niektórych leków w ramach Unii sięgają nawet do 300-400%, więc szybko się okazało, że leki te zaczęły masowo wyjeżdżać z Polski. W efekcie pojawiły się braki niektórych leków dla pacjentów, przy czym były to – i często są nadal, leki istotne z punktu widzenia bezpieczeństwa zdrowotnego kraju, bo ratujące życie.
KC: Dlatego podjęto działania legislacyjne w kierunku uszczelnienia rynku leków w Polsce i zabezpieczenia go przed nadmiernym wywozem; było to zadanie o tyle karkołomne, że, jak wspomniałam wcześniej, handel równoległy jest zjawiskiem, które opiera się na podstawowych zasadach funkcjonowania Unii Europejskiej i którego legalność potwierdził Trybunał Sprawiedliwości UE.
[Jakie zatem podjęto działania legislacyjne?]
AK: Jeszcze w grudniu 2014 roku wprowadzono zakaz sprzedaży leków z apteki do hurtowni czy innej apteki. Był to czas gdy leki przygotowywane na import nie trafiały często w ogóle do systemów sprzedaży aptecznej, a były sprzedawane dalej wprost na fakturach z systemów finansowo-księgowych. Działania takie nie wzbudzały podejrzeń służb skarbowych, bo wszystkie podatki były płacone, równocześnie transakcje te nie były widoczne dla służb związanych z nadzorem farmaceutycznym (WIF czy GIF)
KC: W lipcu 2015 do Prawa farmaceutycznego wprowadzono nową procedurę zgłaszania Głównemu Inspektorowi Farmaceutycznemu zamiaru wywozu z Polski leków z listy tak zwanej antywywozowej – listy produktów zagrożonych brakiem dostępności, którą tworzy i cyklicznie (nie rzadziej niż raz na 2 miesiące) ogłasza Minister Zdrowia. W przypadku otrzymania zgłoszenia Główny Inspektor Farmaceutyczny może skutecznie sprzeciwić się wywozowi w ciągu 30 dni, jeżeli produkt objęty zgłoszeniem faktycznie jest zagrożony brakiem dostępności, a jest on istotny z punktu widzenia zdrowia publicznego. System ten, zdaniem jego autorów, miał uszczelnić rynek leków i sprawić, że problem nadmiernego wywozu zniknie.
[Czy tak się stało?]
KC: Procedura zgłaszania zamiaru wywozu mogła pomóc ograniczyć nadmierny eksport legalny, ale oczywiście nie wyeliminowała zjawiska nielegalnego wywozu leków; a od pewnego czasu to właśnie nielegalne zjawiska, w tym na przykład odwrócony łańcuch dystrybucji (niezgodna z prawem odsprzedaż leku z apteki do hurtowni), odpowiadały w znacznym stopniu za braki leków w aptekach. Dlatego niemal natychmiast po przyjęciu zmian w Prawie farmaceutycznym pojawiły się sygnały, że procedura nie działa, jak należy. Z jednej strony Główny Inspektor Farmaceutyczny został zasypany lawiną zgłoszeń, obejmujących zamiar wywozu pojedynczych opakowań leków; ewidentnie eksporterzy, którzy dokonywali takich zgłoszeń, zastosowali technikę zasypania Głównego Inspektoratu Farmaceutycznego lawiną zgłoszeń, która mogła skutkować niezgłoszeniem sprzeciwów w niektórych sprawach w terminie. Jednocześnie zgłoszenia spływały od kilku zaledwie przedsiębiorców zajmujących się eksportem, co oczywiście nie mogło odzwierciedlać całego rynku.
Kiedy okazało się, że GIF, pomimo ogromnego obłożenia pracą, zdąża z wydawaniem sprzeciwów na czas, zgłoszenia zamiaru wywozu stały się sporadyczne. Czy to oznacza, że eksport leków z listy antywywozowej ustał? Absolutnie nie; należy zatem przyjąć, że znów wzrosła skala zjawisk nielegalnych.
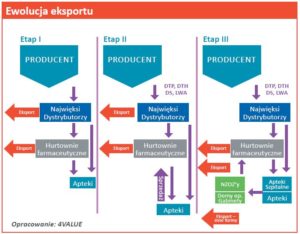
AK: Rynek w tym czasie ewoluował. Najpierw zupełnie legalnym eksportem zajmowali się najwięksi dystrybutorzy i inne hurtownie farmaceutyczne, następnie po wprowadzeniu dedykowanej dystrybucji przez producentów, dołączyły do tego apteki. W kolejnym etapie rynek rozwinął się w kierunku NZOZ’ów, domów opieki, aptek szpitalnych i gabinetów, dodając do tego jeszcze otwarcia oddziałów hurtowni zagranicznych w Polsce. Trzeba zwrócić uwagę także na zupełnie nielegalne formy działań w każdym czasie jak: podwójne systemy ewidencji, wykorzystanie utylizacji leków przechowywanych w niewłaściwych warunkach, błędy w zamówieniach, czy też recepty na fikcyjnych pacjentów.
[Jakie były kolejne zmiany w prawie?]
KC:. Skoro procedura zgłaszania zamiaru wywozu okazała się być nie dość skuteczna, podjęto kolejne próby uszczelnienia rynku poprzez wprowadzenie nowych regulacji. Ograniczeniu eksportu miało służyć wprowadzenie Zintegrowanego Systemu Monitorowania Obrotu Produktami Leczniczymi. ZSMOPL ma pozwalać na precyzyjne określenie ruchu produktu leczniczego w łańcuchu dystrybucji, a tym samym pomóc zidentyfikować ten moment w dystrybucji, gdy produkt opuszcza legalny łańcuch i wyjeżdża z kraju. Niestety prace nad uruchomieniem Systemu nie mogą się skończyć, a jego wejście w życie jest ciągle odsuwane w czasie. Dlatego też powstał inny projekt, dotyczący włączenia leków z listy antywywozowej do zakresu działania Systemu monitorowania drogowego i kolejowego przewozu towarów. Ten System, wdrożony w ubiegłym roku w celu przeciwdziałania przestępstwom skarbowym dotyczącym niektórych rodzajów towarów (np. paliw, papierosów, alkoholu, na których sprzedaży bez akcyzy państwo traci ogromne kwoty), zdaniem Ministerstwa Zdrowia i Ministerstwa Finansów mógł również pomóc lepiej kontrolować obrót lekami zagrożonymi brakiem dostępności.
W związku z tym, w połowie czerwca b.r. weszła w życie kolejna nowelizacja Prawa farmaceutycznego, która połączyła zasady funkcjonowania Systemu monitorowania drogowego i kolejowego przewozu towarów z procedurą zgłaszania Głównemu Inspektorowi Farmaceutycznemu zamiaru wywozu leków z listy antywywozowej. I tak, rozpoczęcie przewozu takich leków w Polsce wymaga zgłoszenia do rejestru zgłoszeń (prowadzonego w systemie teleinformatycznym), zawierającego szczegóły przewozu; a środek transportu przewożący takie leki może być w każdej chwili skontrolowany m.in. przez służby celne, Policję czy Straż Graniczną. W razie powzięcia wątpliwości przez kontrolującego co do legalności przewozu leków z listy antywywozowej (np. w przypadku, gdyby leki były wywożone za granicę bez wcześniejszego zgłoszenia Głównemu Inspektorowi Farmaceutycznemu wywozu), wówczas środek transportu wraz z towarem będzie zatrzymany do czasu wyjaśnienia sprawy. A w przypadku, gdy potwierdzi się niezgodność przewozu z przepisami prawa, na podmiot wysyłający lub odbierający towar będzie nałożona kara finansowa. Tym samym System monitorowania drogowego i kolejowego przewozu towarów daje organom państwa konkretne narzędzia, pozwalające zawsze skontrolować legalność dystrybucji. Wcześniej w kwietniu tego roku zmieniono jeszcze zapisy dotyczące zapotrzebowań wystawianych przez NZOZ aby ograniczyć nadmiarowe zapotrzebowania z tych podmiotów.
[Czy te zmiany mają szansę wyeliminować zjawisko nadmiernego wywozu?]
KC: Obawiam się, że nie. Tak długo, jak ceny leków refundowanych będą istotnie niższe od cen obowiązujących w innych krajach Unii Europejskiej, nie wyeliminujemy nielegalnych form wywozu z tej prostej przyczyny, że proceder eksportowania leków deficytowych nawet wbrew prawu jest po prostu bardzo opłacalny. Dlatego znajdą się z pewnością przedsiębiorcy gotowi ponieść ryzyko kary (a nawet odpowiedzialności karnej, która grozi w przypadku odwróconego łańcucha dystrybucji), w nadziei na duże zyski.
AK: Dla potrzeb tego artykułu zrobiliśmy indywidualne badania dostępności dla dwóch wybranych preparatów z wykazu zagrożonych. Jeden to wiodący preparat przeciwzakrzepowy, drugi to lek dla chorych na cukrzycę. Wybraliśmy losowo 100 aptek (panel 50% sieci, 50% apteki indywidualne). Dostępność w aptece w przypadku pierwszego preparatu była na poziomie 63% tj. w tylu aptekach powiedziano nam, że lek jest – przy czym 90% z tego miało dostępną tylko 1 lub 2 dawki. W przypadku drugiego preparatu 55% miało na stanie z informacją, że jest trudno dostępny. Wiem, że nie można z tego wyciągać żadnych wniosków, jednak to jest to co widzi na co dzień pacjent w aptekach.
O komentarz do ostatnich zmian w Prawie Farmaceutycznym poprosiliśmy Marka Tomkowa (MT) wiceprezesa Naczelnej Rady Aptekarskiej (NRA), który powiedział nam, że w ocenie NRA ostatnie zmiany mogą przynieść oczekiwane efekty:
MT: Dotychczas wywożący nielegalnie leki traktowani byli jako nieuczciwi przedsiębiorcy. Procedowany projekt, uznaje ich za przestępców często działających w zorganizowanych grupach. Zakłada kary nawet do dziesięciu lat pobawienia wolności. Jednocześnie zmienia się rola samej inspekcji farmaceutycznej poprzez nadanie jej uprawnień cechujących służby mundurowe. Nakłada się również ustawowy obowiązek dla wszystkich organów kontrolnych do udzielania pełnej pomocy inspektorom farmaceutycznym. O zmianie podejścia świadczy także fakt, iż ostatnio zatrzymani dostali zarzuty zagrożone ośmioletnią odsiadką.
Po wejściu w życie zapisów ADA (Apteka Dla Aptekarza) „wywozowcy”, którym cofną zezwolenie dostają bilet w jedną stronę. Nie ma możliwości powrotu na rynek pod szyldem innej spółki z o.o.
To już jedenasta próba rozwiązania problemu, miejmy nadzieję, że skuteczna. Na efekty przyjdzie nam poczekać, ponieważ mechanizmy kontroli dopiero zaczynają działać, ale powinny być konkretne.
AK: Odpowiadając na pytanie zadane w temacie artykułu, mamy więc niewątpliwie ogromny sukces krajowych producentów (oraz firm zagranicznych produkujących w Polsce), którzy rozwijają działania eksportowe.
Mamy także wciąż słabość systemu jeśli chodzi o dostępność leków newralgicznych. Z jednej strony eksport równoległy w zakresie leków i produktów leczniczych, które są dostępne w wystarczającej ilości na rynku – był i nadal jest legalny. Z drugiej strony wciąż duże braki określonych leków dla Pacjentów są faktem, mimo kolejnych zakazów, list i przeniesienia tego typu działań w obszar czynności ściganych z mocy prawa. Jak widzieliśmy, po każdej zmianie przepisów rynek dostosowywał się szukając nowych luk w systemie i uruchamiając nowe sposoby wywozu leków. Faktem jest, że wprowadzane narzędzia takie jak ZSMOPL, po uruchomieniu mogą tak jak w przypadku JPK, sygnalizować pewne trendy z wyprzedzaniem. Połączone z wdrożonymi właśnie uprawnieniami dla urzędów i służb operacyjnych, zniechęcą z pewnością część uczestników tego rynku. Wydaje się więc, że rzeka ma szanse zamienić się w strumień, jednak jak będzie naprawdę czas pokarze.
Artykuł został umieszczony w „Pharmaceutical Representative”, oraz zacytowany na portalu rynekaptek.pl: http://www.rynekaptek.pl/marketing-i-zarzadzanie/mamy-duzy-i-ciagle-rosnacy-eksport-lekow,27911_1.html
ZOBACZ TAKŻE: Doradztwo i szkolenia dla farmacji
POBIERZ ARTYKUŁ: Eksport Produktów Farmaceutycznych
Autor: Andrzej Kochanek, Dyrektor Generalny 4Value Business Consulting